PREGUNTAS Y RESPUESTAS FRECUENTES DE LA COMISIÓN DEL COMPENDIO NACIONAL DE INSUMOS PARA LA SALUD
Abreviaturas:
- CNIS: Compendio Nacional de Insumos para la Salud.
- CCNIS: Comisión del Compendio Nacional de Insumos para la Salud
- Reglamento: Reglamento Interior del Compendio Nacional de Insumos para la Salud
- GPC: Guía de Práctica Clínica
- GRADE: Grading of Recommendations, Assessment, Development and Evaluation, por sus siglas en inglés
¿Qué es el CNIS y cada cuándo se publica?
¿Quiénes pueden solicitar la actualización de un insumo para la salud en el CNIS?
¿A quién van dirigidas las solicitudes de actualización de insumos para la salud en el CNIS?
¿Cuál es el plazo máximo para la entrega de información solicitada en la prevención de mi solicitud?
¿Cuál es el plazo máximo para dictaminar la solicitud de mi insumo?
¿Qué sucede si no se presenta la información adicional solicitada por la CCNIS en los tiempos establecidos?
¿Cómo se informa al solicitante del dictamen?
¿Cuál es el órgano colegiado que dictaminará mi solicitud?
¿Cuáles son los tipos de actualización que pueden realizarse al CNIS?
¿Qué requisitos deben de cumplir las solicitudes de inclusión y modificación mayor?
¿Cuál es el mecanismo sugerido para presentar el documento al que se refiere la fracción V del artículo 24 del Reglamento?
¿Cuál es el calendario de sesiones de la Comisión y de sus Comités Técnicos?
¿Quiénes integran la CCNIS?
¿Quiénes integran los Comités Técnicos Específicos de la CCNIS?
¿Cuáles son los Comités Técnicos Específicos de la CCNIS?
¿Puede una misma persona estar en el Comité y en la CCNIS?
¿Cómo puedo dar seguimiento a una solicitud?
¿De cuántas etapas consta el proceso de actualización de insumos, de acuerdo a la Guía de Evaluación de Insumos para la Salud de la CCNIS?
¿Cuál es la metodología sugerida para para evaluar la calidad de la evidencia con base en la Guía de Evaluación de Insumos para la Salud de la CCNIS?
¿Cuáles son los lineamientos técnicos que refiere el Reglamento a seguir para elaborar mi solicitud de actualización?
¿Cuáles insumos no requieren clave del CNIS?
¿Quién determina las adquisiciones de insumos para la salud contenidos en el CNIS?
¿Cuáles son las opciones a comparar dentro de los estudios de evaluación económica que se sugieren?
¿Cuál es el estudio de evaluación económica que se sugiere en cualquier solicitud?
¿Cuándo y dónde puedo entregar mi solicitud de actualización?
¿Dónde puedo enviar mis preguntas respecto del proceso de actualización de mi solicitud?
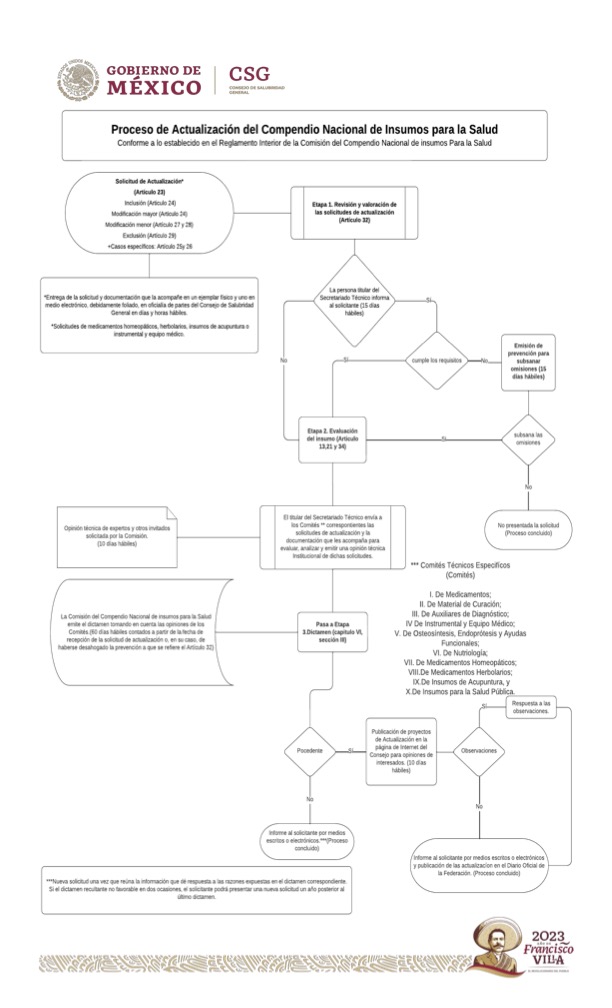
¿Existe un diagrama de flujo del “Proceso de Actualización del CNIS?